Densidade dos gases:
A densidade gasosa pode ser trabalhada sob duas formas densidade absoluta e densidade relativa.
Densidade Absoluta:
A densidade absoluta é uma relação entre a massa e o volume ocupado por um gás, em determinadas condições de temperatura e pressão. Esta densidade pode ser encontrada, levando em consideração a pressão e a temperatura absoluta, partindo da equação de estado do gás ideal:
P.V= n. R.T -> P.V= m/M. R.T -> P.M= m/V.T
Sabendo que: d= m/V -> P.M= d.R.T
Sendo isso, a equação será: d= P.M/R.T.
Densidade Relativa:
A densidade relativa é encontrada através da relação entre as densidades absolutas de dois gases, medidas nas mesmas condições de temperatura e pressão. Esta relação indica quantas vezes um gás é mais denso ou menos denso que outro gás.
d1/d2= M1/M2.
Anotações do Professor Túlio Acesso em:24-09-2014 às 14:36.
quarta-feira, 19 de novembro de 2014
Equação de Clapeyron
As leis de Boylee e Charles/ Gay- Lussac podem ser combinadas com a lei de Avogadro para relacionar volume, pressão, temperatura e quantidade de mols de um gás.
V= n.R.T
Tal relação é chamada de equação de um gás. Onde R representa constante de proporcionalidade e é chamada universal dos gases.
Esta equação também é denominada de equação de Clapeyron.
R= 0,082 atm.L.mol-1.K-1. Esete valor deve ser usado quando mol.K da pressão está em atm.
R=62,3 mmHg.L.mol-1.K-1. Este valor é usado quando mol.K da pressão está em mmHg.
Anotações do Professor Túlio Acesso em: 16-09-2014 às 15:07.
V= n.R.T
Tal relação é chamada de equação de um gás. Onde R representa constante de proporcionalidade e é chamada universal dos gases.
Esta equação também é denominada de equação de Clapeyron.
R= 0,082 atm.L.mol-1.K-1. Esete valor deve ser usado quando mol.K da pressão está em atm.
R=62,3 mmHg.L.mol-1.K-1. Este valor é usado quando mol.K da pressão está em mmHg.
Anotações do Professor Túlio Acesso em: 16-09-2014 às 15:07.
quarta-feira, 12 de novembro de 2014
Como funciona o bafômetro?
O bafômetro é um aparelho que permite determinar a concentração de
bebida alcoólica considerando o ar exalado dos pulmões de uma pessoa. É
também conhecido pela denominação técnica “etilômetro”, devido às
reações que envolvem o álcool etílico presente na baforada do suspeito e
um reagente.
Todos os tipos de bafômetros são baseados em reações químicas, e os reagentes mais comuns são dicromato de potássio e célula de combustível. A diferença entre estes dois reagentes é que o dicromato muda de cor na presença do álcool enquanto a célula gera uma corrente elétrica.O mais usado pelos policiais no Brasil é o de Célula de combustível. Veja a química desse bafômetro a seguir:
1. O álcool expirado reage com o oxigênio presente no aparelho, esta reação ocorre com a ajuda de um catalisador;
2. Um chip presente dentro do aparelho calcula a porcentagem e dá a concentração de álcool no sangue.
Disponível em: http://www.brasilescola.com/quimica/como-funciona-bafometro.htm Acesso em: 22/10/2014 às 14:27.
Todos os tipos de bafômetros são baseados em reações químicas, e os reagentes mais comuns são dicromato de potássio e célula de combustível. A diferença entre estes dois reagentes é que o dicromato muda de cor na presença do álcool enquanto a célula gera uma corrente elétrica.O mais usado pelos policiais no Brasil é o de Célula de combustível. Veja a química desse bafômetro a seguir:
1. O álcool expirado reage com o oxigênio presente no aparelho, esta reação ocorre com a ajuda de um catalisador;
2. Um chip presente dentro do aparelho calcula a porcentagem e dá a concentração de álcool no sangue.
Disponível em: http://www.brasilescola.com/quimica/como-funciona-bafometro.htm Acesso em: 22/10/2014 às 14:27.
quarta-feira, 5 de novembro de 2014
O que é ebola?
Ebola é uma doença causada por um vírus de mesmo nome, e seu principal sintoma é a febre hemorrágica, que causa sangramentos em órgãos internos. O vírus é nativo da África, onde surtos esporádicos ocorrem ao longo de décadas.
É uma doença grave e muitas vezes fatal, com uma taxa de letalidade de até 90%, segundo dados da Organização Mundial de Saúde (OMS). O ebola é transmitido pelo contato direto com o sangue, fluidos corporais e tecidos de animais ou pessoas infectadas. Pacientes gravemente doentes requerem tratamento de suporte intensivo. Durante um surto, aqueles com maior risco de infecção são os profissionais de saúde, familiares e outras pessoas em contato próximo com pessoas doentes e pacientes falecidos.
O vírus Ebola foi descoberto em 1976 e acontecem surtos esporádicos desde então. Os primeiros registros do vírus Ebola foram encontrados em macacos, chimpanzés eoutros primatas não humanos que vivem na África. Uma cepa mais branda de Ebola foi descoberta em macacos e porcos nas Filipinas - no entanto, o vírus das Filipinas não causa doença em humanos. A doença recebe esse nome por causa do rio Ebola, na República Democrática do Congo, onde o vírus foi encontrado pela primeira vez.
Hoje, o que se acredita é que o morcego seja o responsável por transmitir o vírus para outros animais. Nele o vírus não provoca doença. Mas uma fruta meio comida por um morcego e encontrada por outro animal já pode dar início à epidemia. Macacos, antílopes e porcos-espinho também são afetados pela doença. É possível entrar em contato com o vírus visitando lugares com infestação de morcegos (como minas e cavernas) ou manipulando o tecido de algum animal morto pelo Ebola.
É uma doença grave e muitas vezes fatal, com uma taxa de letalidade de até 90%, segundo dados da Organização Mundial de Saúde (OMS). O ebola é transmitido pelo contato direto com o sangue, fluidos corporais e tecidos de animais ou pessoas infectadas. Pacientes gravemente doentes requerem tratamento de suporte intensivo. Durante um surto, aqueles com maior risco de infecção são os profissionais de saúde, familiares e outras pessoas em contato próximo com pessoas doentes e pacientes falecidos.
O vírus Ebola foi descoberto em 1976 e acontecem surtos esporádicos desde então. Os primeiros registros do vírus Ebola foram encontrados em macacos, chimpanzés e
Hoje, o que se acredita é que o morcego seja o responsável por transmitir o vírus para outros animais. Nele o vírus não provoca doença. Mas uma fruta meio comida por um morcego e encontrada por outro animal já pode dar início à epidemia. Macacos, antílopes e porcos-espinho também são afetados pela doença. É possível entrar em contato com o vírus visitando lugares com infestação de morcegos (como minas e cavernas) ou manipulando o tecido de algum animal morto pelo Ebola.
Disponível em: http://www.minhavida.com.br/saude/temas/ebola Acesso em: 05/10/2014 às 13:08.
Da fotografia ao tratamento do ebola: a surpreendente transformação da Fujifilm
Depois de um espetacular processo de diversificação de suas atividades, a Fujifilm Holdings, grupo associado ao mundo da fotografia, produziu o Avigan, o medicamento que lidera a corrida para acabar com o Ebola.
A molécula em questão, o favipiravir (o "T-705"), foi desenvolvida pela Toyama Chemical, uma filial do grupo. Comercializado com o nome de Avigan, o medicamento seria um anti-gripal, mas as experiências em ratos indicam eficiência contra o Ebola.
Em novembro, os testes para avaliar seus efeitos em humanos começarão na Guiné, um dos países mais afetados pela atual epidemia.

Disponível em: http://noticias.ne10.uol.com.br/saude/noticia/2014/10/27/da-fotografia-ao-tratamento-do-ebola-a-surpreendente-transformacao-da-fujifilm-516515.php Acesso em: 29/10/2014 às 13:11.
A molécula em questão, o favipiravir (o "T-705"), foi desenvolvida pela Toyama Chemical, uma filial do grupo. Comercializado com o nome de Avigan, o medicamento seria um anti-gripal, mas as experiências em ratos indicam eficiência contra o Ebola.
Em novembro, os testes para avaliar seus efeitos em humanos começarão na Guiné, um dos países mais afetados pela atual epidemia.
Disponível em: http://noticias.ne10.uol.com.br/saude/noticia/2014/10/27/da-fotografia-ao-tratamento-do-ebola-a-surpreendente-transformacao-da-fujifilm-516515.php Acesso em: 29/10/2014 às 13:11.
quarta-feira, 29 de outubro de 2014
Qual a diferença de desodorantes e antitranspirantes?
O suor é uma importante função do corpo humano que controla a nossa temperatura e aumenta a hidratação da pele. Ao evaporar, o suor retira calor do corpo, fazendo com que ele se resfrie. O problema consiste nas bactérias presentes em nossa pele que decompõem as substâncias liberadas pelo suor em outras de odor desagradável.
• Desodorantes: eles agem no controle das bactérias presentes na derme da pele. Com a diminuição das atividades microbianas, o odor é mascarado. O principal constituinte da maioria dos desodorantes é o triclosan. Os desodorantes também podem conter álcool e essências. Visto que essas bactérias se proliferam em meio ácido, a neutralização desse meio com substâncias básicas, como o hidróxido de magnésio (Mg(OH)2), presente no leite de magnésia, ou o bicarbonato de sódio (NaHCO3), presente também em talcos desodorantes, pode provocar a morte desses microrganismos.
• Antiperspirantes (antitranspirantes): seu objetivo é inibir a transpiração, mantendo o corpo relativamente seco. Isso é feito por meio de cátions que causam o fechamento dos dutos das glândulas sudoríparas. Um cátion que faz isso por coagular proteínas é o alumínio (Al3+), que é produzido pelo cloridrato de alumínio (Al2(OH)5Cl).
Disponível em: https://www.facebook.com/CuriosidadesSobreAQuimica Acesso em: 12/10/2014 às 12:05.
• Desodorantes: eles agem no controle das bactérias presentes na derme da pele. Com a diminuição das atividades microbianas, o odor é mascarado. O principal constituinte da maioria dos desodorantes é o triclosan. Os desodorantes também podem conter álcool e essências. Visto que essas bactérias se proliferam em meio ácido, a neutralização desse meio com substâncias básicas, como o hidróxido de magnésio (Mg(OH)2), presente no leite de magnésia, ou o bicarbonato de sódio (NaHCO3), presente também em talcos desodorantes, pode provocar a morte desses microrganismos.
• Antiperspirantes (antitranspirantes): seu objetivo é inibir a transpiração, mantendo o corpo relativamente seco. Isso é feito por meio de cátions que causam o fechamento dos dutos das glândulas sudoríparas. Um cátion que faz isso por coagular proteínas é o alumínio (Al3+), que é produzido pelo cloridrato de alumínio (Al2(OH)5Cl).
Disponível em: https://www.facebook.com/CuriosidadesSobreAQuimica Acesso em: 12/10/2014 às 12:05.
quarta-feira, 22 de outubro de 2014
Caril e cúrmula para cuidar do cérebro
A cúrcuma, uma prima do gengibre é uma das principais especiarias do caril. A cúrcuma é especialmente rica em curcumina, um composto que inibe a doença de Alzheimer. Ele não só bloqueia a formação de placas de amilóide beta, como também impede a inflamação dos neurônios e reduz o colesterol que entope as artérias (o que poderia reduzir o fluxo sanguíneo para o cérebro).


Disponivel em: https://www.facebook.com/jan1297?ref=ts&fref=ts Acesso em: 23-09-2014 às 13:35.
O que é caril?
O caril é uma mistura de especiarias muito utilizada na culinária de países como Índia e Tailândia . É também um preparado típico da culinária indo-portuguesa de Goa, Damão e Diu.
O "pó-de-caril" é feito à base de pó de açafrão-da-terra, cardamomo, coentro, gengibre, cominho, casca de noz-moscada, cravinho, pimenta e canela. Para além destes ingredientes básicos, outros são incluídos, de acordo com as preferências: alforva, pimenta-de-caiena, cominhos finos, noz-moscada, pimenta-da-jamaica, pimentão e alecrim.
Disponível em: http://pt.wikipedia.org/wiki/Caril Acesso em: 08-10-2014 às 13:21.
quarta-feira, 1 de outubro de 2014
Pressão parcial
A pressão da mistura gasosa (P) corresponde à soma das pressões exercidas pelo gás A e o gás B dentro do recipiente. A pressão de cada gás exerce na mistura gasosa é chamada de pressão parcial. Portanto podemos enunciar a lei de Dalton ( das pressões parcias) que diz: a pressão total corresponde à soma das pressões parciais dos gases componentes da mistura gasosa.
P= pA+pB, onde P é a pressão total, p é a pressão parcial.
Para o cálculo da pressão parcial podemos utilizar:
Equação de estado: pA.V= nA.R.T e pB.V=NB.R.T
Equação geral: Como a quantidade em mols de cada gás não varia, podemos falar:
PA. V/T e PB.V/T
Anotações do Professor Túlio Acesso em: 24-09-2014 às 15:16.
P= pA+pB, onde P é a pressão total, p é a pressão parcial.
Para o cálculo da pressão parcial podemos utilizar:
Equação de estado: pA.V= nA.R.T e pB.V=NB.R.T
Equação geral: Como a quantidade em mols de cada gás não varia, podemos falar:
PA. V/T e PB.V/T
Anotações do Professor Túlio Acesso em: 24-09-2014 às 15:16.
Difusão e Efusão dos Gases
A difusão de um gás é um movimento espontâneo de um gás através do outro, isto é, seu espalhamento em outro meio gasoso. Essa mistura de gases origina misturas homogêneas. Por exemplo, os gases que saem das chaminés das fábricas, ou dos escapamentos dos carros, se espalham pelo ar atmosférico, e com o passar do tempo não conseguimos distingui-los, pois houve uma difusão desses gases pelo ar.
Efusão dos gases é um tipo particular de difusão, em que há o vazamento dos gases através de pequeno orifício. Por exemplo, os balões vendidos para crianças, são preenchidos com gás hélio. Com o passar do tempo, esse gás acaba passando pelos poros da borracha do balão, ou seja, há a sua efusão. Isso é constatado pelo fato de o balão murchar após algumas horas.
O químico escocês Thomas Graham, em 1829, estudou esse comportamento dos gases. Ele concluiu que a velocidade com que um gás se difundia ou efundia em outro está relacionada com a sua densidade. Com isso, criou a seguinte lei:
Lei de Graham: a velocidade de difusão ou efusão de um gás é inversamente proporcional à raiz quadrada de sua densidade.
Ou, relacionando dois gases diferentes, temos:
A unidade usada nesse caso é o '' volume que escapa por unidade de tempo'', sendo, portanto, geralmente L/min.
Efusão dos gases é um tipo particular de difusão, em que há o vazamento dos gases através de pequeno orifício. Por exemplo, os balões vendidos para crianças, são preenchidos com gás hélio. Com o passar do tempo, esse gás acaba passando pelos poros da borracha do balão, ou seja, há a sua efusão. Isso é constatado pelo fato de o balão murchar após algumas horas.
O químico escocês Thomas Graham, em 1829, estudou esse comportamento dos gases. Ele concluiu que a velocidade com que um gás se difundia ou efundia em outro está relacionada com a sua densidade. Com isso, criou a seguinte lei:
Lei de Graham: a velocidade de difusão ou efusão de um gás é inversamente proporcional à raiz quadrada de sua densidade.
Ou, relacionando dois gases diferentes, temos:
A unidade usada nesse caso é o '' volume que escapa por unidade de tempo'', sendo, portanto, geralmente L/min.
Assim, gases com menos densidade difundem mais rapidamente. Se estiver na mesma condição de temperatura e pressão, pode-se também fazer uma relação disso com a massa molar do gás: quanto maior densidade do gás, maior será a sua massa molar e menor a sua velocidade de difusão e vice- versa.
Desse modo temos:
Anotações do Professor Túlio Acesso em: 24-04-2014 às 15:33.
Condições Normais de Temperautra e Pressão ( CNTP)
São definidas como condições normais de temperatura e pressão quando o gás é submetido a uma pressão de 1atm e a temperatura de 0°C. Portanto, podemos colocar: P = 1atm = 760mmH; T = 0°C = 273K.
Lei de Avogadro: Volumes iguais de gases quaisquer, à mesma temperatura e pressão, encerram o mesmo número de moléculas. Sendo n a quantidade de matéria em mol de cada gás.
Determinou-se experimentalmente o volume ocupado por 1 mol de qualquer gás nas CNTP e foi encontrado o valor aproximadamente igual a 22,4 L. Portanto, podemos dizer que: Volume molar de qualquer gás nas CNTP= 22,4 L.
Anotações do Professor Túlio Acesso em: 16-09-2014 às 14:45.
Lei de Avogadro: Volumes iguais de gases quaisquer, à mesma temperatura e pressão, encerram o mesmo número de moléculas. Sendo n a quantidade de matéria em mol de cada gás.
Determinou-se experimentalmente o volume ocupado por 1 mol de qualquer gás nas CNTP e foi encontrado o valor aproximadamente igual a 22,4 L. Portanto, podemos dizer que: Volume molar de qualquer gás nas CNTP= 22,4 L.
Anotações do Professor Túlio Acesso em: 16-09-2014 às 14:45.
Gás Perfeito ou Ideal,Gás Real e Equação geral dos Gases,
- Gás Perfeito ou Ideal: Obedece rigorosamente às Leis Físicas dos Gases em quaisquer condições de temperatura e pressão.
- Gás Real: Não segue o mesmo comportamento do Gás Ideal, principalmente em pressões muito altas ou baixas, pois ocorre alta redução de volume e as partículas próximas, passam a interferir umas no movimento das outras. Um Gás real aproxima-se do comportamento de um gás ideal à medida que diminui a pressão e aumenta a temperatura.
- Equação Geral dos Gases: Esta equação é utilizada quando ocorre transformação gasosa em que as três variáveis de estado ( pressão, volume e temperatura) se modificam simultaneamente.
Anotações do Professor Túlio Acesso em: 16-09-2014 às 14:33.
quarta-feira, 17 de setembro de 2014
Projeto de química orienta alunos sobre refeições
Projeto desenvolvido nas aulas de química contribuiu para mudar os hábitos alimentares dos estudantes do ensino médio do Instituto Estadual de Educação Aimone Soares Carriconde, em Arroio Grande (RS). “Os alunos tornaram-se mais críticos a respeito dos produtos vendidos na cantina e apresentaram sugestões de cardápio para a merenda escolar”, diz o professor Ivan Nunes Gonçalves.
De acordo com Ivan, ao estudarem conteúdos relacionados a termo química, os alunos tiveram a oportunidade de aprender sobre as calorias dos alimentos. Então, após discussões e debates sobre o cardápio da merenda da escola, sugeriram alterações. Dentre elas, a inclusão de frutas variadas. O professor explica que os estudantes organizaram diferentes cardápios, sempre atendendo às necessidades de calorias diárias recomendadas.
Além da conscientização dos alunos sobre a importância de uma alimentação saudável, o projeto acrescentou conhecimento sobre os processos de armazenamento e conservação de alimentos. Ivan destaca a realização de oficinas para ensinar pais e alunos a verificar os aditivos contidos nos produtos e se eles são necessários ou não. “Muitos alunos mudaram radicalmente hábitos alimentares e, além disso, passaram a realizar atividades físicas”, revela.
De acordo com Ivan, ao estudarem conteúdos relacionados a termo química, os alunos tiveram a oportunidade de aprender sobre as calorias dos alimentos. Então, após discussões e debates sobre o cardápio da merenda da escola, sugeriram alterações. Dentre elas, a inclusão de frutas variadas. O professor explica que os estudantes organizaram diferentes cardápios, sempre atendendo às necessidades de calorias diárias recomendadas.
Além da conscientização dos alunos sobre a importância de uma alimentação saudável, o projeto acrescentou conhecimento sobre os processos de armazenamento e conservação de alimentos. Ivan destaca a realização de oficinas para ensinar pais e alunos a verificar os aditivos contidos nos produtos e se eles são necessários ou não. “Muitos alunos mudaram radicalmente hábitos alimentares e, além disso, passaram a realizar atividades físicas”, revela.
Disponível em: http://www.infonet.com.br/educacao/ler.asp?id=163214 Acesso em: 15-09-2014 às 12:25.
Comer ''besteiras'' vicia?
Depois de uma pesquisa afirmar que comer "besteiras" vicia,
outros cientistas chegaram à conclusão que alimentos ricos em açúcar ou
gordura não deixam as pessoas dependentes químicas. Segundo eles, o
cérebro não responde aos nutrientes da mesma forma como quando há o uso
de drogas como a heroína ou a cocaína, por exemplo. Mas, as pessoas podem desenvolver uma compulsão psicológica
por comer, impulsionadas pelos sentimentos positivos que estão
associados com a alimentação, o que configuraria um distúrbio de
comportamento, como o vício em jogos, dizem os cientistas da
Universidade de Edimburgo.
Disponível em: http://diariocatarinense.clicrbs.com.br/sc/noticia/2014/09/comer-e-viciante-mas-acucar-e-gordura-nao-sao-como-drogas-diz-estudo-4594373.html Acesso em: 10-09-2014 às 15:42.
Qual a idade da terra?
A Terra tem 4,56 bilhões de anos
Como se sabe?
1. O decaimento radioativo faz com que os átomos de urânio percam partículas nucleares, transformando-o em chumbo.
2. Conhecendo o tempo de meia-vida do urânio e medindo a quantidade de urânio e de chumbo nas rochas mais antigas da Terra, calculou-se a idade do planeta.
Disponível em: https://www.facebook.com/bluedottt Acesso em: 10-09-2014 às 15:34.
Como se sabe?
1. O decaimento radioativo faz com que os átomos de urânio percam partículas nucleares, transformando-o em chumbo.
2. Conhecendo o tempo de meia-vida do urânio e medindo a quantidade de urânio e de chumbo nas rochas mais antigas da Terra, calculou-se a idade do planeta.
Disponível em: https://www.facebook.com/bluedottt Acesso em: 10-09-2014 às 15:34.
quarta-feira, 10 de setembro de 2014
Por que nos dias frios ou chuvosos, o lado interno dos vidros dos carro ficam embaçado ?
Em dias chuvosos, a temperatura no interior do carro geralmente é maior do que a de fora, com isso, as moléculas de água que se encontram vaporizadas no interior do carro são condensadas em razão da diferença de temperatura. Quando as moléculas da água vaporizada (estado gasoso) são condensadas (liquido) elas se agregam ao vidro, tornando-o translúcido.
Disponível em: https://www.facebook.com/CuriosidadesQueAQuimicaResponde?fref=ts Acesso em: 05-10-2014 às 12:31.
Disponível em: https://www.facebook.com/CuriosidadesQueAQuimicaResponde?fref=ts Acesso em: 05-10-2014 às 12:31.
Por que o FORMOL usado para alisar o cabelo faz mal a saúde e quebra todo o cabelo ?
O uso dessa substância é proibido em produtos alisantes em concentrações superiores a 0,2%.
Em concentrações mais altas, pode irritar o couro cabeludo e também as
mucosas ocular e respiratória do cliente e do cabeleireiro.
Hoje há diversas formas seguras de alisar os cabelos. Várias substâncias químicas podem ser usadas com esse fim, as mais seguras são: tioglicolato de amônio, ácido tioglicólico, carbocisteína, guanidina e hidróxido de potássio, disponíveis em concentrações variadas em produtos alisantes.
Disponível em: https://www.facebook.com/CuriosidadesQueAQuimicaResponde?fref=ts Acesso em: 03/09/2014 às 14:24.
Hoje há diversas formas seguras de alisar os cabelos. Várias substâncias químicas podem ser usadas com esse fim, as mais seguras são: tioglicolato de amônio, ácido tioglicólico, carbocisteína, guanidina e hidróxido de potássio, disponíveis em concentrações variadas em produtos alisantes.
Disponível em: https://www.facebook.com/CuriosidadesQueAQuimicaResponde?fref=ts Acesso em: 03/09/2014 às 14:24.
Dessalinização da água
No planeta Terra, as águas cobrem 3/4 da superfície, mas cerca de 97,2 % destas
são salgadas.
Na natureza, a dessalinização é um processo natural, alimentador do Ciclo
hidrológico, que é um sistema físico. Devido à ação da energia solar, ocorre a evaporação de um grande volume de água dos oceanos, dos mares e dos continentes. Os sais permanecem na solução e os vapores, por condensação, vão formar as nuvens, as quais originam as chuvas e outras formas de precipitação. Esta água doce, por gravidade, volta aos oceanos e mares, alimentando os rios, os lagos, as lagoas.
Por necessidade de sobrevivência, o homem desenvolveu métodos e técnicas de dessalinização das águas com elevado conteúdo salino para obter água doce.
Há vários métodos conhecidos para se fazer a conversão, mas apenas dois deles
representam 88% da dessalinização global: a osmose inversa e a destilação
multiestágios.
• Osmose inversa: Quando a pressão sobre a solução aumenta fazendo com que
haja a separação da água e do sal.
• Dessalinização térmica: Quando a água salgada é evaporada artificialmente e
depois condensada. Esse processo separa a água e o sal.
• Congelamento: Outro processo envolve o congelamento da água, pois somente a
• Congelamento: Outro processo envolve o congelamento da água, pois somente a
água pode ser congelada (os sais não congelam junto). O processo é basicamente a
extração de sais minerais da água através do congelamento.
• Destilação multiestágios: Utiliza-se vapor a alta temperatura para fazer a água do
• Destilação multiestágios: Utiliza-se vapor a alta temperatura para fazer a água do
mar entrar em ebulição. São multiestágios pois a água passa por diversas células de
ebulição-condensação, garantindo um elevado grau de pureza. Neste processo, a
própria água do mar é usada como condensador da água que é evaporada.
• Destilação por forno solar: o forno solar tem como função concentrar os raios solares numa zona especifica, graças a um espelho parabólico.
• Destilação por forno solar: o forno solar tem como função concentrar os raios solares numa zona especifica, graças a um espelho parabólico.
Disponível em: https://mail.google.com/mail/#inbox/148318fd8013deeb?projector=1Acesso em: 02-06-2014 às 16:00.
Curiosidades: Fazer xixi no mar é prejudicial tanto para o mar quanto as pessoas?
O xixi é, literalmente, uma gota no oceano. O Oceano Atlântico, por exemplo, tem 350 quintilhões de litros de água. Se todas as 7 bilhões de pessoas fizessem xixi no mar, a quantidade de ureia no mar seria de aproximadamente 60 partes por trilhão. Uma quantia insignificante para as dimensões marinhas.
95% da urina humana é água. O sódio e o cloro, substâncias presentes na urina, estão em 96.5% da água do mar. Além disso, a urina contém muito nitrogênio. Quando essa substância reage com a água forma amônia, que alimenta as algas.Tudo isso sem contar que todos os animais marinhos urinam no oceano. Uma baleia jubarte, por exemplo, joga no mar 970 litros de urina por dia.
Portanto, fazer xixi no mar não faz mal.
95% da urina humana é água. O sódio e o cloro, substâncias presentes na urina, estão em 96.5% da água do mar. Além disso, a urina contém muito nitrogênio. Quando essa substância reage com a água forma amônia, que alimenta as algas.Tudo isso sem contar que todos os animais marinhos urinam no oceano. Uma baleia jubarte, por exemplo, joga no mar 970 litros de urina por dia.
Portanto, fazer xixi no mar não faz mal.
Disponível em: http://info.abril.com.br/noticias/tecnologias-verdes/2014/08 Acesso em: 25-08-2014.
Curiosidade: Carne Seca é obtida através da química
A carne-seca, produto comum no Norte e no Nordeste do Brasil,
pode ser obtida pela salga (adição de sal). O sal retira a água da carne
por osmose, que é um processo espontâneo onde o solvente vai da região mais diluída (interior da carne) para a região mais concentrada (lado externo que contém sal).
A retirada da água retarda a reprodução de micro-organismos evitando que a carne se estrague.
Disponível em: https://www.facebook.com/CuriosidadesQueAQuimicaResponde?fref=ts Acesso em: 20/08/2014 às 16:15.
A retirada da água retarda a reprodução de micro-organismos evitando que a carne se estrague.
Disponível em: https://www.facebook.com/CuriosidadesQueAQuimicaResponde?fref=ts Acesso em: 20/08/2014 às 16:15.
quarta-feira, 3 de setembro de 2014
Leis Físicas dos Gases
Uma dada massa de gás sofre uma transformação quando ocorrem variações nas suas variáveis de estado.
- Lei de Boyle- Mariotte: '' À temperatura constante, uma determinada massa de gás ocupa um volume inversamente proporcional à pressão exercida sobre ele''. Esta transformação gasosa, onde a temperatura é mantida constante, é chamada de transformação isotérmica. Portanto, podemos representar: P1.V1=P2.V2
- Lei de Charles: ''À pressão constante, o volume ocupado por uma massa fixa de gás é diretamente proporcional à temperatura absoluta''. Esta transformação gasosa, onde a pressão é mantida constante é chamada de transformação isobárica. Com isso, representa-se: V1/T1=V2/T2.
- Lei de Gay- Lussac:''A um volume constante, a pressão exercida por uma determinada massa fixa de gás é diretamente proporcional à temperatura absoluta''. Esta transformação gasosa, onde o volume é mantido constante, é denominada de transformação isocórica, isométrica ou isovolumétrica. Com isso, representa: P1/T1=P2/T2.
Transformações Gasosas
Todo gás é constituído por partículas que estão em contínuo movimento desordenado. Esse movimento, com um grande número de partículas, provocam colisões entre elas e, por isso, sua trajetória não é retilínea num espaço apreciável, mas sim caminham em ziguezague. Essas colisões podem ser consideradas perfeitamente elásticas.
O estado em que se apresenta um gás é caracterizado por três variáveis: volume, temperatura e pressão.
Anotações do professor Túlio Acesso em: 20/08/2014 às 14:49.
O estado em que se apresenta um gás é caracterizado por três variáveis: volume, temperatura e pressão.
- Volume: O volume de qualquer substância é o espaço ocupado por esta substância. No caso dos gases, o volume é igual ao volume do recipiente que o contém. As unidades usuais são: litro(L), mililitro(mL), metro cúbico(m³), decímetro cúbico(dm³) e centímetro cúbico (cm³).
- Temperatura: É a medida do grau de agitação térmica das partículas que constituem uma substância. No caso dos gases, é utilizada a escala absoluta ou Kelvin(K) e, no Brasil, a escala usual é o Celsius(°C). Portanto, para transformar graus Celsius(t) em Kelvin(T) é: T= t+273.
- Pressão: A pressão é definida como força por unidade de área. No estado gasoso, a pressão é o resultado do choque de suas moléculas contra as paredes do recipiente que as contém. A medida da pressão de um gás é feita através de um aparelho chamado manômetro. As unidades de pressão usuais são: atmosfera(atm), centímetros de mercúrio(cmHg), milímetro de mercúrio(mmHg), Torricelli(torr). 1atm= 76cmHg= 760mmHg.
Anotações do professor Túlio Acesso em: 20/08/2014 às 14:49.
Por que o ímã não se fixa no alumínio?
Um ímã só se fixa em metais nos quais todos os
elétrons giram no mesmo plano e no mesmo sentido, ou seja, possuem
campos magnéticos arrumados. Mas em alguns metais não são assim. Por exemplo: o alumínio, onde os campos magnéticos gerados em torno de cada átomo acabam se anulando.
Ao girar ao redor do núcleo, os elétrons criam um pequeno campo magnético. No ferro por exemplo, com sua organização dos campos, haverá sempre regiões de "domínios", sempre orientando o campo para um mesmo lado.
Os ímãs também possuem domínios que seguem na mesma direção, logo tende a fixar apenas nesses materiais com campos alinhados.
Disponível em: https://facebook.com/CuriosidadesQueAQuimicaResponde Acesso em: 02/07/2014 às 15:26.
Ao girar ao redor do núcleo, os elétrons criam um pequeno campo magnético. No ferro por exemplo, com sua organização dos campos, haverá sempre regiões de "domínios", sempre orientando o campo para um mesmo lado.
Os ímãs também possuem domínios que seguem na mesma direção, logo tende a fixar apenas nesses materiais com campos alinhados.
Disponível em: https://facebook.com/CuriosidadesQueAQuimicaResponde Acesso em: 02/07/2014 às 15:26.
quarta-feira, 2 de julho de 2014
Curiosidades do chocolate
Chocolate protetor do coração
O flavonoide epicatequina do chocolate amargo, que também é encontrado no chá verde, estimula o aumento do bom colesterol, HDL, e a diminuição do ruim, LDL. O colesterol ruim pode oxidar, entupir o vaso sanguíneo e levar a problemas no coração. Mas, os flavonoides ajudam a dilatar as artérias, permitindo melhor circulação do sangue.
E chocolate também possui a teobromina é uma substância estimulante que age no sistema nervoso central e também no sistema muscular, permitindo o bom funcionamento do coração.
Chocolate traz a sensação de felicidade

A feniletilamina estimula a produção de endorfinas e serotonina no cérebro, que dá a sensação de felicidade e prazer, pois ela pode acionar a liberação de dopamina, substância química do cérebro que causa a sensação de felicidade. E ainda o chocolate ajuda combater a depressão, hipertensão, tumores e até o stress da TPM.
Disponível em: http://mundoconectado.net/bem-estar Acesso em: 02/07/2014 às 14:29.
O flavonoide epicatequina do chocolate amargo, que também é encontrado no chá verde, estimula o aumento do bom colesterol, HDL, e a diminuição do ruim, LDL. O colesterol ruim pode oxidar, entupir o vaso sanguíneo e levar a problemas no coração. Mas, os flavonoides ajudam a dilatar as artérias, permitindo melhor circulação do sangue.
E chocolate também possui a teobromina é uma substância estimulante que age no sistema nervoso central e também no sistema muscular, permitindo o bom funcionamento do coração.
Chocolate traz a sensação de felicidade
A feniletilamina estimula a produção de endorfinas e serotonina no cérebro, que dá a sensação de felicidade e prazer, pois ela pode acionar a liberação de dopamina, substância química do cérebro que causa a sensação de felicidade. E ainda o chocolate ajuda combater a depressão, hipertensão, tumores e até o stress da TPM.
Disponível em: http://mundoconectado.net/bem-estar Acesso em: 02/07/2014 às 14:29.
segunda-feira, 30 de junho de 2014
Chocolate previne o envelhecimento
Quando comparados a outros alimentos com alta capacidade antioxidante
como chá verde, maçã, blueberrie e vinho tinto, o cacau é o que possui
maior teor de polifenóis, de ação antioxidante, com destaque especial
para as epicatequinas. Estas protegem o organismo contra os danos
oxidativos causados pelos radicais livres e que podem acelerar o
processo de envelhecimento.
O cacau também contém procianidinas que atuam tanto na prevenção
contra o excesso de radicais livres, quanto no seu “ataque”,
neutralizando sua ação no organismo, prevenindo, dessa forma, contra o
envelhecimento precoce. O consumo regular de cacau nos protege contra os
danos causados pela poluição e exposição ao sol.
Disponível em: http://mundoconectado.net/ Acesso em: 31-06-2014 às 14:57.
Química no futebol
1º A euforia no Futebol
A dopamina é um neurotransmissor da alegria e da felicidade que é
responsável pelo descargo de emoções para coração e as artérias.
2º Campo de Futebol
Para manter um campo de futebol com relva verde, firme ,uniforme e
para que a bola possa rolar melhor, utiliza-se fertilizantes agrícolas,
como por exemplo:
superfosfato triplo (originado a partir de fosfatos), cloreto de potássio, sulfato de amónio.
3º A Bola
As primeiras bolas eram feitas com couro de boi, só depois da Copa
Mundial de 1978 na Argentina, é que as bolas começaram a serem feitas
por cloreto de vinila, sendo o seu nome IUPAC, cloroeteno.
Mas a tecnologia evolui e as bolas atuais são feitas com revestimento
de poliuretano, com camadas de poliestireno e na câmara é usada uma
borracha butílica. O poliestireno é um plástico que se obtém por
polimerização do estireno. A borracha butílica é uma matéria-prima de borracha, sendo
especialmente robusta e absorvente. Um exemplo de uma bola com estes
materiais é a “Jabulani” .
O cloreto de vinila também se encontra nas bandeiras, cobertura das cadeiras do estádio e até no apito do árbitro.
4º A Baliza
As redes da baliza são feitas de Nylon. O Nylon pertence à família
das poliamidas. Através do estiramento, os fios de Nylon ficam com uma
grande resistência à tração. Não se queimam facilmente e possuem uma
ótima resistência aos agentes químicos.
5º As chuteiras
Para o jogador ter segurança e estabilidade dentro de campo, as
chuteiras são feitas de polipropileno (é um polímero que vem do propeno)
e de resinas de poliuretano. Com isto, elas tornam-se mais leves e
resistentes.
6º As vestimentos
As vestimentas são feitas por microfibras de poliéster para que seja
confortável e leve para o jogador e difícil de ser rasgadas pelos
puxões.
7º Outros materiais
A química também existe:
- Nas tintas para pintar a cara, os pigmentos constituintes das
tintas são compostos químicos insolúveis em água e em substâncias
oleosas. Um exemplo de pigmento é o dióxido de titânio (TiO2),
composto de coloração branca que tem as mais variadas aplicações, desde
tintas até produtos de confeitaria e protetores solares.
- Nas cornetas ou vuvuzelas que são feitas por polietileno.
- Os tambores, que antes eram feitos por couro de animal e agora são por fibras de poliéster.
- No fogo de artifício, onde podemos ver a combustão que é um processo de
liberação de calor. A combustão inicial provoca a rápida
ascensão do foguete que a certa altura explode violentamente. Conforme o
elemento químico adicionado, podem ser obtidas várias cores. Os
elementos são adicionados na forma de sais que contém os metais que
emitem a coloração. Quando os elétrons destes metais passam para um
nível de energia superior e retornam para um de menor
energia, eles emitem uma cor característica pertencente a cada metal. Os
sais mais comuns são o NaCl e o KNO3.
Disponível em: http://13moleculasapular.wordpress.com/ Acesso em: 31-06-2014 às 14:26.
segunda-feira, 16 de junho de 2014
Câncer pode ser provocado por adesivos de nicotina para deixar de fumar
Os adesivos e pastilhas de nicotina que ajudam a largar o vício de fumar podem aumentar o risco da pessoa contrair um câncer.
Há um risco para os fumantes que tentam deixar o hábito e recorrem a adesivos e pastilhas: isso podem aumentar o risco da pessoa sofrer de câncer.A conclusão foi obtida através de um estudo à nicotina realizado no Instituto de Bioinformática de Virginia, nos EUA, citado pelo jornal Daily Mail.
Embora se saiba que a substância é viciante, mas nunca foi catalogada como cancerígena. Só que, de acordo com a investigação realizada nos EUA, a nicotina é responsável por determinadas alterações celulares, as quais podem estar na origem de futuros tumores.
| A nicotina é um dos químicos mais utilizados em produtos para ajudar a deixar o vício de fumar, como em adesivos e pastilhas. |
Disponível em: http://www.ptjornal.com/2014061623671/geral/saude. Acesso em: 16/06-2014 às 16:51.
Pintar cabelo aumenta o risco de câncer
Tingir e fazer permanente em cabelo não parece oferecer muito perigo à saúde, mas um estudo publicado recentemente no periódico Occupational and Environmental Medicine encontrou concentrações mais altas de uma
substância cancerígena no sangue de cabeleireiros. Segundo
especialistas, os indícios são um motivo a mais para que as tinturas e
outros produtos químicos usados em salões de beleza sejam investigados com mais atenção pelos cientistas.
O oncologista Cristiano Guedes Duque, da Oncoclínica do Rio de Janeiro, diz que o estudo mostra que outros produtos, além do formol, merecem atenção dos institutos de saúde e pesquisa. “Os salões de beleza são repletos de substâncias voláteis que são absorvidas pelas mucosas e podem resultar em cânceres que se manifestam anos depois”, diz o também médico do Instituto Nacional de Câncer (Inca).
Rodrigo Medeiros, especialista da unidade de Brasília do Centro de Oncologia do Hospital Sírio-Libanês, acredita que a maioria dos cabeleireiros não sabe dos riscos constatados na pesquisa de Johansson. “Em longo prazo, essas substâncias resultam em uma série de doenças, como o câncer de bexiga, que é muito agressivo. O tratamento é sofrido, e as chances de cura são muito baixas se o diagnóstico demorar a ser feito”.
Disponível em: http://boainformacao.com.br/2014/06/ Acesso em: 16/06/2014 às 14:52.
O oncologista Cristiano Guedes Duque, da Oncoclínica do Rio de Janeiro, diz que o estudo mostra que outros produtos, além do formol, merecem atenção dos institutos de saúde e pesquisa. “Os salões de beleza são repletos de substâncias voláteis que são absorvidas pelas mucosas e podem resultar em cânceres que se manifestam anos depois”, diz o também médico do Instituto Nacional de Câncer (Inca).
Rodrigo Medeiros, especialista da unidade de Brasília do Centro de Oncologia do Hospital Sírio-Libanês, acredita que a maioria dos cabeleireiros não sabe dos riscos constatados na pesquisa de Johansson. “Em longo prazo, essas substâncias resultam em uma série de doenças, como o câncer de bexiga, que é muito agressivo. O tratamento é sofrido, e as chances de cura são muito baixas se o diagnóstico demorar a ser feito”.
Disponível em: http://boainformacao.com.br/2014/06/ Acesso em: 16/06/2014 às 14:52.
Por que a pilha alcalina dura cerca de 4 vezes mais que uma pilha comum?
A pilha comum é formada por um cilindro de zinco metálico, que funciona como ânodo. O cátodo é o eletrodo central e é feito de
grafite coberto por uma camada de dióxido de manganês e carvão em pó,
envolvidos por uma pasta úmida contendo cloreto de amônio e cloreto de
zinco.
A pilha alcalina é composta de um ânodo de zinco poroso imerso em uma solução fortemente alcalina de KOH ou NaOH, e um cátodo de dióxido de manganês .
A pilha alcalina dura de cerca de 4 vezes mais além de fornecer correntes mais elevadas, porque o hidróxido de potássio ou sódio é melhor condutor eletrolítico do que o cloreto de amônio, e como também não há formação de amônia gasosa, não ocorre polarização do cátodo, o que já ocorre nas pilhas comuns.
Disponívelem:facebook.com/CuriosidadesQueAQuimicaResponde Acesso em: 06-02-201 às 14:54.
A pilha alcalina é composta de um ânodo de zinco poroso imerso em uma solução fortemente alcalina de KOH ou NaOH, e um cátodo de dióxido de manganês .
A pilha alcalina dura de cerca de 4 vezes mais além de fornecer correntes mais elevadas, porque o hidróxido de potássio ou sódio é melhor condutor eletrolítico do que o cloreto de amônio, e como também não há formação de amônia gasosa, não ocorre polarização do cátodo, o que já ocorre nas pilhas comuns.
Disponívelem:facebook.com/CuriosidadesQueAQuimicaResponde Acesso em: 06-02-201 às 14:54.
Por que a água da torneira evapora a menos de 100ºC?
A água que entra em ebuição a 100º é a água pura (temperatura medida ao nível do mar). A
água que sai da torneira tem outras substâncias como o cloro, que pode
diminuir o ponto de vaporização.
Outro fator é que as moléculas de um liquido, a qualquer temperatura, encontram-se em constante agitação, movendo-se em todas as direções, com velocidades variáveis. Algumas moléculas, com velocidades suficientemente elevadas, ao alcançarem a superfície, conseguem escapar do "seio" liquido. Após escaparem, estas moléculas passam a uma situação em que se encontram muito afastadas umas das outras, de modo que a força entre elas é praticamente nula, isto é, elas se encontram no estado "GASOSO".
Outro fator é que as moléculas de um liquido, a qualquer temperatura, encontram-se em constante agitação, movendo-se em todas as direções, com velocidades variáveis. Algumas moléculas, com velocidades suficientemente elevadas, ao alcançarem a superfície, conseguem escapar do "seio" liquido. Após escaparem, estas moléculas passam a uma situação em que se encontram muito afastadas umas das outras, de modo que a força entre elas é praticamente nula, isto é, elas se encontram no estado "GASOSO".
Disponível em: https://www.facebook.com Acesso em: 09-06-2014 às 15:01.
segunda-feira, 2 de junho de 2014
Por que a bala Halls fornece sensação de refrescância na boca?
O Mentol, encontrada na hortelã comum está presente em Drops bastante
conhecidos como a bala Halls. O Mentol, na verdade, é o nome usual do 2-
isopropil-5-metil-1-ciclohexanol, sendo
portanto um Álcool, e a razão de frescor desta substância deve-se ao
fato que em contato com as células das mucosas bucais - essas mais
sensíveis e com uma temperatura corporal - o álcool irá evaporar,
fornecendo a sensação de frio aparente. Por esta razão, o Mentol ira
desencadear na boca uma sensação de suave refrescância.
Disponível em: https://www.facebook.com/CuriosidadesQueAQuimicaResponde Acesso em: 02-06-2014 às 15:48.
Disponível em: https://www.facebook.com/CuriosidadesQueAQuimicaResponde Acesso em: 02-06-2014 às 15:48.
Panela de pressão
A panela de pressão permite que os
nossos alimentos sejam cozidos em água muito mais rapidamente do que em
panelas convencionais. Devido a uma borracha de vedação, ocorre a
retenção de parte do vapor produzido, gerando assim um aumento na
pressão interna na panela. Devido a isso, a água ferve acima de 100ºC,
uma temperatura acima da água numa panela convencional, fazendo com que
os alimentos sejam cozidos com mais rapidez.
Disponível em: http://www.mundodaquimica.com.br Acesso em: 02-06-2014 às 14:42.
Gasolina
A gasolina, obtida pela destilação fracionada do
petróleo tem sofrido modificações com a evolução da indústria
petrolífera e dos motores de combustão interna. Os hidrocarbonetos,
componentes da gasolina, são membros da série parafínica, olefínica,
naftênica e aromática, e suas proporções relativas dependem do petróleo
e dos processos de produção utilizados. Hoje em dia, as gasolinas que
saem das refinarias são formadas de misturas criteriosamente
balanceadas desses hidrocarbonetos, visando atender aos requisitos de
desempenho dos motores.
Uma gasolina para consumo é composta pela mistura
de dois, três ou mais componentes obtidos em diferentes processos de
refino, e ainda recebe a adição de outros compostos como: tolueno,
xilenos, etanol anidro, metanol entre outros, com
finalidades específicas, dentre elas os antioxidantes e antidetonantes.
Disponível em: http://www.soq.com.br/ Acesso em: 02-06-2014 às 14:37.
segunda-feira, 26 de maio de 2014
Scanner potátil ajuda a revelar 'composição química' de objetos
Uma startup israelense criou um dispositivo que revela
instantaneamente a composição química de diferentes objetos, de comida a
joias, passando por medicamentos e até plantas. Isso
permite saber, por exemplo, se uma maçã tem agrotóxicos ou se uma joia
não passa de uma bijouteria barata.
Do tamanho de uma caixa de fósforos, o pequeno aparelho foi inventado
pela empresa Consumer Physics, sediada em Tel-Aviv, que desenvolveu o primeiro espectrômetro (instrumento ótico usado para
medir as propriedades da luz) molecular barato e de fácil acessibilidade.
O dispositivo é semelhante a um scanner de mão: o usuário
aponta o equipamento em direção a um objeto, pressiona um botão que
emite uma luz azul e, alguns segundos depois, há as informações sobre
sua composição química.
Dror Sharon, co-fundador da Consumer Physics, diz que a
invenção, nomeada de SCiO, pode se tornar um “Google” para o mundo
físico, ou seja, uma maneira de buscar e descobrir instantaneamente a
composição dos objetos ao nosso redor.
Suspensões
São sistemas heterogêneos nos quais é possível visualizar o disperso a olho nu ou com o auxílio de um microscópio. Para separar as substâncias desses sistemas, pode-se utilizar um filtro comum.
Exemplo: Solução de hidróxido de magnésio (Mg(OH)2).
Anotações do professor Túlio Acesso em: 26-05-2014 às 14:26.
Exemplo: Solução de hidróxido de magnésio (Mg(OH)2).
Anotações do professor Túlio Acesso em: 26-05-2014 às 14:26.
Dispersões coloidais
Apesar de serem misturas heterogêneas, não é sempre que as dispersões coloidais podem ser distinguidas visualmente das soluções e somente quando são utilizados ultrafiltros ou centrifugas é que se podem observar o soluto.
Quando um feixe de luz atravessa uma dispersão coloidal, é possível visualizar a trajetória dos feixes de luz. Esse fenômeno é conhecido como efeito Tyndall e podemos observá-lo quando a luz solar passa através do ar empoeirado ou com gotículas de água.
Anotações do professor Túlio Acesso em: 26-05-2014 às 14:22.
Quando um feixe de luz atravessa uma dispersão coloidal, é possível visualizar a trajetória dos feixes de luz. Esse fenômeno é conhecido como efeito Tyndall e podemos observá-lo quando a luz solar passa através do ar empoeirado ou com gotículas de água.
Anotações do professor Túlio Acesso em: 26-05-2014 às 14:22.
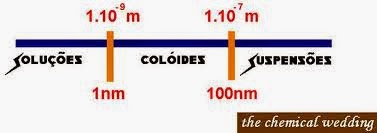
Dispersões
Nas dispersões, o soluto está disperso ao longo de todo o volume do dispergente. As dispersões podem ser classificadas de acordo com o tamanho das partículas que as compõem:
Anotações do professor Túlio Acesso em: 26-05-2014 às 14:15.
Anotações do professor Túlio Acesso em: 26-05-2014 às 14:15.
segunda-feira, 19 de maio de 2014
Banhado a ouro significa dar um banho de ouro?
O nome deste processo é chamado de galvanização ou eletrodeposição. Um metal, como o alumínio, por exemplo é revestido de ouro. Para banhar de ouro um anel feito de alumínio, o anel será o cátodo ligado a uma pilha de polo negativo. E no polo positivo, o ânodo deverá ser uma lâmina de ouro. Os eletrodos devem estar mergulhados em um sal de ouro, como o nitrato de ouro. Desta forma, o ouro irá se depositar no anel de alumínio. Pode-se dizer então, que o alumínio foi mergulhado em ouro (sal), então é banhado a ouro.
Disponível em: http://www.soq.com.br/ Acesso em: 17-05-2014 às 15:00.
Solubilidade ou Coeficiente de solubilidade
- Quantidade máxima de soluto que pode ser dissolvida em uma quantidade fixa de solvente, em uma determinada temperatura e pressão.
- Alterações na temperatura e na pressão em que o experimento é realizado fazem com que a solubilidade de um soluto em determinado solvente aumente ou diminua.
- As curvas de solubilidade são gráficos que indicam como a solubilidade de uma substância é influenciada pela variação da temperatura.
Anotações do Professor Túlio Acesso em: 19-05-2014 às 14:40.
Propriedades das soluções
- As partículas do soluto são invisíveis mesmo quando observadas em microscópio eletrônico.
- As partículas do soluto não se depositam.
- As partículas do soluto não são retiradas por nenhum filtro conhecido.
- As partículas do soluto não conseguem, dispersar um feixe de luz que incida sobre elas.
- Ao se retirar amostras ( alíquota) de uma solução, em todas elas a relação quantidade de soluto/ quantidade de solvente permanece constante e inalterado.
Solução aquosa de NaCl
Água + Sal
Anotações da aula do Professor Túlio Acesso em: 19-05-2014 às 14:30.
Por que um alimento é mais calórico que outro?
Os alimentos contêm valores energéticos. São geralmente encontrados em calorias (cal) ou em quilocalorias (Kcal).
Esses “valores energéticos” correspondem à energia liberada nas reações químicas do metabolismo desses alimentos no organismo.
Se dizemos que o chocolate tem muita caloria, na verdade queremos dizer que nas reações do metabolismo do chocolate no organismo, há liberação de muita energia. Disponível em: http://www.soq.com.br/ Acesso: 16-05-2014 às 14:00. |
Qual a diferença entre concentração comum e densidade?
A diferença entre concentração comum e densidade é que na concentração comum
se relaciona a massa de soluto com o volume da solução e, na densidade,
a massa de solução com o volume da solução.
Disponível em: http://www.infoescola.com/ Acesso em: 12-04-2014 às 14:17.
Disponível em: http://www.infoescola.com/ Acesso em: 12-04-2014 às 14:17.
Sacarose
Popularmente conhecida como açúcar comum ou açúcar de mesa, a sacarose é
um dissacarídeo composto por uma molécula de glicose e uma de frutose,
unidas entre si por uma ligação glicosídica. Esse
glicídio tem aparência de cristais brancos, sabor doce e é solúvel em
água.
A sacarose tem origem vegetal, sendo encontrada, principalmente, na cana de açúcar e na beterraba e em algumas frutas.
Devido ao clima favorável, no Brasil e na Austrália, o açúcar é obtido a
partir da cristalização do caldo de cana, que apresenta uma
concentração de sacarose entre 14% e 24%. Já na Europa, se produz açúcar
a partir da beterraba, cuja concentração de sacarose é de 14% a 18%.
O açúcar é classificado de acordo com o teor de sacarose:
Quando submetida à ação de ácidos diluídos ou da enzima invertase, a sacarose sofre hidrólise e libera a molécula de glicose e a de frutose que fazem parte da sua estrutura, numa reação química denominada inversão de sacarose.
Essa reação é aplicada à produção de chocolates com recheios cremosos:
na fabricação, o chocolate é recheado com sacarose, água e invertase,
que reagem entre si e formam uma mistura de glicose e frutose,
denominada açúcar invertido, mais cremoso e muito mais doce do que a
própria sacarose.
Esse dissacarídeo é utilizado como referencial de doçura,
tanto de açúcares orgânicos quanto de adoçantes artificiais. Em termos
de doçura, 100 g de glicose, por exemplo, equivalem a 74 g de sacarose,
enquanto 100 g de frutose correspondem a 173 g de sacarose. Os adoçantes
artificiais, em geral, são produzidos com doçura bem maior que a
sacarose, como é o caso da sacarina: 100 g de sacarose equivalem a
35.000 g de sacarina.
Inicialmente, o açúcar não era algo tão comum
como é hoje em dia. Até o século XIX, usava-se o mel de abelhas para
adoçar alimentos e bebidas, e o próprio açúcar era utilizado quase
exclusivamente para fins medicinais, como um calmante natural. No
entanto, com a propagação da cana de açúcar no continente americano e do
açúcar de beterraba nos países europeus, o produto passou a ser mais conhecido e consumido mundialmente, deixando de ser apenas um item de luxo.
Disponível em: http://www.infoescola.com Acesso em: 12-05-2014 às 14:38. |
Assinar:
Comentários (Atom)